Cara mencari elektron valensi – Pernahkah kamu bertanya-tanya mengapa atom-atom bisa saling berikatan dan membentuk molekul yang beragam? Rahasianya terletak pada elektron valensi, si kecil yang lincah dan menentukan sifat kimia suatu unsur. Bayangkan elektron valensi sebagai duta kecil yang bertugas mencari pasangan untuk membentuk ikatan, seperti seorang cupid yang mengantarkan cinta antar atom! Nah, dalam artikel ini, kita akan mengungkap cara menentukan elektron valensi dengan mudah, tanpa perlu menjadi ahli kimia ulung.
Siapkan pensil dan kertas, mari kita mulai petualangan kita ke dunia atom!
Elektron valensi merupakan elektron yang berada di kulit terluar atom. Mereka adalah pemain kunci dalam pembentukan ikatan kimia, karena mereka yang terlibat dalam interaksi dengan atom lain. Elektron valensi menentukan sifat kimia suatu unsur, seperti reaktivitas dan jenis ikatan yang dibentuk. Untuk menentukan elektron valensi, kita perlu memahami konfigurasi elektron, yaitu susunan elektron dalam setiap kulit atom.
Pengertian Elektron Valensi
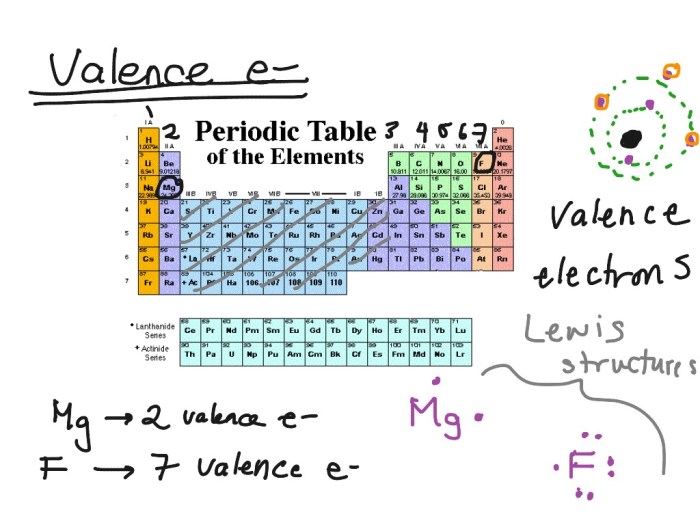
Bayangkan atom seperti sebuah kota kecil dengan penduduk yang tinggal di berbagai distrik. Elektron, partikel bermuatan negatif, adalah penduduknya. Mereka tinggal di berbagai kulit atau “distrik” yang mengelilingi inti atom. Nah, elektron valensi adalah penduduk yang tinggal di distrik terluar, yang paling dekat dengan “perbatasan” atom. Mereka adalah para “penduduk tepi” yang paling aktif dan suka berinteraksi dengan penduduk kota lain.
Mau cari elektron valensi? Tenang, gak usah pusing kayak lagi nyari file gambar CorelDraw yang tiba-tiba ilang! Coba inget-inget lagi tabel periodik, itu kunci utamanya. Eh, ngomong-ngomong soal CorelDraw, kamu tau gak sih bagaimana cara mengexport gambar coreldraw ? Nah, kalau udah bisa export gambar CorelDraw, kamu bisa langsung pamerin karya seni kamu di mana-mana, sama kayak kamu pamerin pengetahuan tentang elektron valensi.
😎
Elektron valensi ini berperan penting dalam membentuk “hubungan” antara atom, yang kita kenal sebagai ikatan kimia.
Definisi Elektron Valensi
Elektron valensi adalah elektron yang berada pada kulit terluar atom. Mereka adalah elektron yang paling mudah dilepaskan atau ditangkap ketika atom berikatan dengan atom lain. Bayangkan mereka seperti para “diplomat” yang suka bertukar informasi dan membangun hubungan dengan “diplomat” dari kota lain.
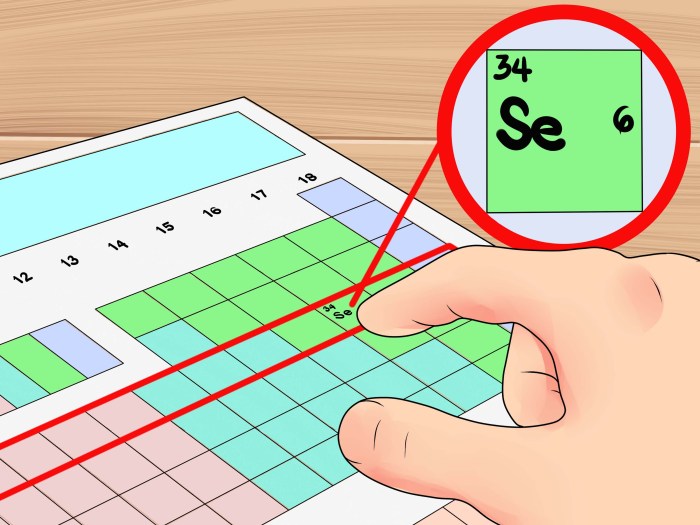
Cari elektron valensi? Tenang, gampang kok! Kayak nyampur warna, tinggal lihat angka di kolom terakhir tabel periodik. Misal, kalo kamu mau cari elektron valensi oksigen, liat aja angka 6 di kolom terakhir tabel periodik. Nah, buat nyampur warna, kamu bisa cek cara mencampur warna yang ada di internet. Sama aja kayak nyari elektron valensi, cuma bedanya, kamu ngga perlu khawatir soal konfigurasi elektron!
Peran Elektron Valensi dalam Pembentukan Ikatan Kimia
Elektron valensi adalah kunci utama dalam pembentukan ikatan kimia. Mereka bertanggung jawab untuk “menjembatani” dua atom yang berbeda, membentuk ikatan yang kuat. Ada tiga jenis ikatan kimia utama:
- Ikatan Ionik: Bayangkan dua kota yang saling berdekatan. Kota A memiliki penduduk “diplomat” yang suka melepas elektron, sementara kota B memiliki penduduk “diplomat” yang suka menerima elektron. Ketika “diplomat” dari kota A bertemu “diplomat” dari kota B, terjadilah transfer elektron. Kota A menjadi “bermuatan positif” karena kehilangan elektron, sementara kota B menjadi “bermuatan negatif” karena menerima elektron. Perbedaan muatan ini membuat kedua kota saling tertarik dan membentuk ikatan ionik.
- Ikatan Kovalen: Bayangkan dua kota yang sama-sama memiliki “diplomat” yang suka berbagi elektron. Mereka saling “berbagi” elektron, membentuk ikatan kovalen. Bayangkan mereka seperti dua sahabat yang saling meminjamkan mainan.
- Ikatan Logam: Bayangkan sebuah kota besar dengan banyak “diplomat” yang bebas bergerak dan saling berbagi elektron. Elektron-elektron ini membentuk “awan elektron” yang menyelubungi seluruh kota, sehingga atom-atom logam dapat bergerak bebas dan membentuk ikatan logam.
Contoh Ilustrasi Struktur Atom yang Menunjukkan Elektron Valensi
Misalnya, atom karbon memiliki 6 elektron. 2 elektron berada di kulit pertama, dan 4 elektron lainnya berada di kulit kedua. Keempat elektron di kulit kedua ini adalah elektron valensi. Mereka bertanggung jawab untuk membentuk empat ikatan kovalen dengan atom lain, seperti hidrogen, oksigen, dan nitrogen.
Cari elektron valensi? Mudah banget! Coba deh inget-inget tabel periodik, kayak nyari alamat rumah di peta. Nah, kalau gigi kamu berlubang, jangan panik! Tenang, kamu bisa cari tau cara menambal gigi berlubang di internet. Begitu juga dengan elektron valensi, banyak banget sumber belajar online yang bisa kamu akses. Jadi, tenang aja, urusan kimia dan gigi berlubang bisa diselesaikan dengan mudah!
Atom karbon memiliki konfigurasi elektron 2,4, yang berarti memiliki 4 elektron valensi.
Cara Menentukan Elektron Valensi: Cara Mencari Elektron Valensi
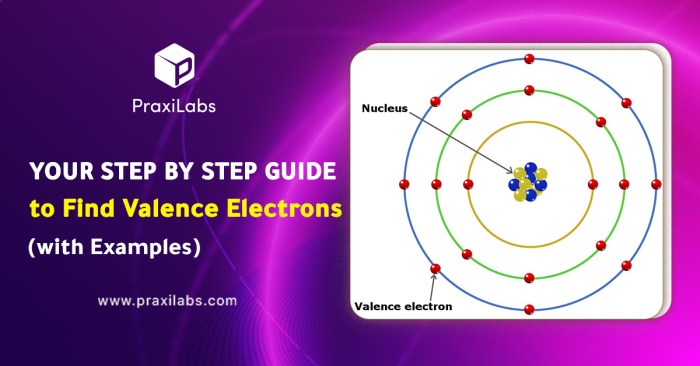
Oke, siap untuk menyelami dunia elektron valensi? Bayangkan atom-atom kecil seperti rumah-rumah mungil, dan elektron valensi adalah penghuni yang suka bergaul di teras rumah. Mereka yang paling aktif, yang menentukan bagaimana atom berinteraksi dengan tetangganya. Nah, bagaimana kita bisa menemukan penghuni teras ini?
Cari elektron valensi? Gampang banget! Tinggal liat golongan atomnya di tabel periodik. Nah, kalo urusan jodoh, bagaimanakah cara memilih jodoh istri atau suami menurut islam , jangan lupa liat “golongan”nya juga! Bukan golongan darah, tapi golongan hati yang baik, taat, dan bertanggung jawab. Sama kayak elektron valensi, cari yang “stabil” dan “cocok” buat kamu.
Konfigurasi Elektron: Peta Rumah Atom
Untuk menemukan elektron valensi, kita perlu memahami konfigurasi elektron, yaitu peta yang menunjukkan bagaimana elektron-elektron tersusun di dalam atom. Bayangkan konfigurasi elektron seperti denah rumah yang menunjukkan ruangan-ruangan dan jumlah penghuni di setiap ruangan.
Berikut tabel konfigurasi elektron untuk 10 unsur pertama dalam tabel periodik:
| Unsur | Nomor Atom | Konfigurasi Elektron |
|---|---|---|
| Hidrogen (H) | 1 | 1s1 |
| Helium (He) | 2 | 1s2 |
| Litium (Li) | 3 | 1s22s1 |
| Berilium (Be) | 4 | 1s22s2 |
| Boron (B) | 5 | 1s22s22p1 |
| Karbon (C) | 6 | 1s22s22p2 |
| Nitrogen (N) | 7 | 1s22s22p3 |
| Oksigen (O) | 8 | 1s22s22p4 |
| Fluor (F) | 9 | 1s22s22p5 |
| Neon (Ne) | 10 | 1s22s22p6 |
Menentukan Elektron Valensi: Mencari Penghuni Teras
Setelah kita memiliki denah rumah atom (konfigurasi elektron), kita bisa mencari penghuni teras (elektron valensi). Elektron valensi adalah elektron yang berada di kulit terluar atom.
- Kulit terluar adalah kulit dengan nomor kulit terbesar dalam konfigurasi elektron.
- Elektron valensi adalah elektron yang menempati kulit terluar.
Contoh: Nitrogen (N) dan Sulfur (S)
Mari kita cari elektron valensi untuk nitrogen (N) dan sulfur (S).
- Nitrogen (N): Konfigurasi elektron nitrogen adalah 1s 22s 22p 3. Kulit terluarnya adalah kulit kedua (2s 22p 3), yang berisi 5 elektron (2s 2 + 2p 3 = 5). Jadi, nitrogen memiliki 5 elektron valensi.
- Sulfur (S): Konfigurasi elektron sulfur adalah 1s 22s 22p 63s 23p 4. Kulit terluarnya adalah kulit ketiga (3s 23p 4), yang berisi 6 elektron (3s 2 + 3p 4 = 6). Jadi, sulfur memiliki 6 elektron valensi.
Elektron Valensi dan Sifat Kimia
Elektron valensi adalah elektron yang berada di kulit terluar atom. Elektron-elektron ini adalah yang paling mudah terlibat dalam ikatan kimia, sehingga sangat menentukan sifat kimia suatu unsur. Bayangkan elektron valensi seperti anak-anak yang suka bergaul, mereka selalu ingin berinteraksi dengan anak-anak lain (atom lain) untuk bermain bersama (membentuk ikatan kimia). Nah, sifat kimia suatu unsur, seperti reaktivitas dan jenis ikatan yang dibentuk, sangat dipengaruhi oleh jumlah dan bagaimana elektron valensi ini berinteraksi.
Pengaruh Elektron Valensi pada Sifat Kimia
Jumlah elektron valensi yang dimiliki suatu atom menentukan bagaimana atom tersebut akan berinteraksi dengan atom lain. Unsur dengan elektron valensi yang hampir penuh (misalnya, golongan VIIA/17) cenderung menerima elektron untuk mencapai konfigurasi elektron stabil seperti gas mulia. Mereka sangat reaktif dan mudah membentuk ikatan ionik dengan unsur yang memiliki elektron valensi sedikit. Sebaliknya, unsur dengan sedikit elektron valensi (misalnya, golongan IA/1) cenderung melepaskan elektron untuk mencapai konfigurasi elektron stabil.
Mereka juga sangat reaktif dan mudah membentuk ikatan ionik dengan unsur yang memiliki banyak elektron valensi.
Perbedaan Jumlah Elektron Valensi dalam Satu Golongan, Cara mencari elektron valensi
Perhatikan unsur-unsur dalam satu golongan, seperti golongan IA/1 (alkali). Semua unsur dalam golongan ini memiliki satu elektron valensi. Hal ini menyebabkan mereka memiliki sifat kimia yang serupa, yaitu sangat reaktif dan mudah membentuk ikatan ionik dengan unsur non-logam. Contohnya, Lithium (Li), Natrium (Na), dan Kalium (K) mudah bereaksi dengan air membentuk larutan basa dan melepaskan gas hidrogen. Semakin ke bawah dalam golongan, ukuran atom semakin besar, sehingga elektron valensi lebih mudah dilepas, membuat reaktivitas unsur tersebut semakin tinggi.
Hubungan Elektron Valensi dan Sifat Periodik Unsur
Elektron valensi juga terkait erat dengan sifat periodik unsur. Periode dalam tabel periodik menunjukkan jumlah kulit elektron yang dimiliki atom. Jumlah elektron valensi pada atom menentukan golongan atau kolom tempat atom tersebut berada dalam tabel periodik. Contohnya, unsur-unsur dalam golongan IA/1 memiliki satu elektron valensi, unsur-unsur dalam golongan IIA/2 memiliki dua elektron valensi, dan seterusnya.
- Jari-jari atom: Jari-jari atom adalah jarak antara inti atom dengan elektron terluar. Semakin banyak elektron valensi, semakin kuat tarik menarik antara inti atom dan elektron valensi, sehingga jari-jari atom menjadi lebih kecil.
- Energi ionisasi: Energi ionisasi adalah energi minimum yang dibutuhkan untuk melepaskan satu elektron dari atom dalam keadaan gas. Semakin banyak elektron valensi, semakin sulit untuk melepaskan elektron, sehingga energi ionisasi semakin tinggi.
- Elektronegativitas: Elektronegativitas adalah kemampuan suatu atom untuk menarik elektron dalam ikatan kimia. Semakin banyak elektron valensi, semakin kuat kemampuan atom untuk menarik elektron, sehingga elektronegativitas semakin tinggi.
Contoh Penerapan Pencarian Elektron Valensi
Oke, mari kita turun ke lapangan dan lihat bagaimana mencari elektron valensi benar-benar berguna dalam dunia kimia. Bayangkan kamu seperti seorang detektif kimia, dan elektron valensi adalah petunjuk utamamu untuk mengungkap misteri rumus kimia dan ikatan!
Menentukan Rumus Kimia Senyawa
Elektron valensi adalah kunci untuk memahami bagaimana atom saling berikatan dan membentuk senyawa. Bayangkan kamu sedang membangun LEGO, tapi kali ini LEGO-nya adalah atom. Setiap atom memiliki “pasak” (elektron valensi) yang ingin mereka hubungkan dengan “pasak” atom lainnya untuk membentuk struktur yang stabil. Dengan mengetahui jumlah elektron valensi, kita bisa memprediksi bagaimana atom akan berikatan dan membentuk rumus kimia senyawa.
- Misalnya, natrium (Na) memiliki 1 elektron valensi, sedangkan klorin (Cl) memiliki 7 elektron valensi. Natrium ingin “menyingkirkan” elektron valensinya untuk mencapai konfigurasi elektron yang stabil, sementara klorin ingin “menambahkan” 1 elektron untuk mencapai konfigurasi yang stabil. Nah, natrium “memberikan” elektron valensinya kepada klorin, membentuk ion Na+ dan Cl-. Karena muatan berlawanan menarik, kedua ion ini kemudian berikatan membentuk senyawa ionik NaCl (garam dapur).
Peran Elektron Valensi dalam Pembentukan Ikatan
Seperti yang kita ketahui, ada dua jenis ikatan utama: ikatan ion dan ikatan kovalen. Elektron valensi memainkan peran penting dalam menentukan jenis ikatan yang terbentuk.
- Ikatan Ion: Dalam ikatan ion, satu atom (biasanya logam) “memberikan” elektron valensinya kepada atom lain (biasanya non-logam). Atom yang kehilangan elektron menjadi ion positif, sedangkan atom yang menerima elektron menjadi ion negatif. Kedua ion kemudian tertarik satu sama lain karena muatan yang berlawanan, membentuk ikatan ion.
- Ikatan Kovalen: Dalam ikatan kovalen, atom-atom berbagi elektron valensi. Atom-atom yang terlibat dalam ikatan kovalen biasanya memiliki elektronegativitas yang serupa, sehingga mereka tidak cenderung untuk “memberikan” atau “menerima” elektron sepenuhnya. Mereka malah “berbagi” elektron untuk mencapai konfigurasi elektron yang stabil.
Ilustrasi Pembentukan Ikatan Kimia
Bayangkan atom hidrogen (H) dengan 1 elektron valensi dan atom oksigen (O) dengan 6 elektron valensi. Hidrogen membutuhkan 1 elektron lagi untuk mencapai konfigurasi elektron yang stabil, sementara oksigen membutuhkan 2 elektron lagi. Oleh karena itu, dua atom hidrogen akan berbagi elektron valensinya dengan atom oksigen, membentuk molekul air (H2O).
Ilustrasi: Atom oksigen dengan 6 elektron valensi (ditunjukkan sebagai titik merah) berbagi elektron valensinya dengan 2 atom hidrogen (ditunjukkan sebagai titik biru) membentuk molekul air (H2O). Elektron yang dibagikan ditunjukkan sebagai titik hijau.
