Suatu katalis mempercepat reaksi dengan cara meningkatkan – Bayangkan sebuah pesta di mana semua orang berdiri canggung, tidak tahu harus memulai percakapan dari mana. Begitulah reaksi kimia tanpa katalis: lambat dan tak efisien. Tapi, datanglah seorang katalis, seperti seorang pembawa acara yang energik, yang dengan cekatan mempertemukan molekul-molekul, mendorong mereka untuk bereaksi dan menciptakan keajaiban kimia.
Katalis: Mempercepat reaksi dengan meningkatkan energi aktivasi, seperti memindahkan pesta dari suasana canggung ke lantai dansa yang penuh semangat.
Katalis adalah zat ajaib yang berperan sebagai penengah dalam reaksi kimia, mempercepat proses tanpa terkonsumsi dalam reaksi itu sendiri. Mereka bekerja dengan cara menurunkan energi aktivasi, yaitu energi minimum yang dibutuhkan untuk memulai reaksi. Bayangkan sebuah gunung yang harus didaki untuk mencapai puncak, katalis seperti membangun sebuah jalan setapak yang lebih landai, sehingga lebih mudah untuk mencapai puncak.
Dengan kata lain, katalis membuat reaksi kimia berjalan lebih cepat dan efisien.
Cara Kerja Katalis: Suatu Katalis Mempercepat Reaksi Dengan Cara Meningkatkan
Bayangkan kamu sedang membuat kue, tapi adonanmu keras dan susah diuleni. Kamu butuh bantuan, kan? Nah, katalis itu seperti si “bantuan” dalam reaksi kimia. Mereka tidak ikut dalam reaksi, tapi mereka mempercepat prosesnya, membuat reaksi lebih cepat dan efisien.
Meningkatkan Energi Aktivasi
Katalis bekerja dengan cara menurunkan energi aktivasi reaksi. Energi aktivasi adalah seperti “hambatan” yang harus dilewati reaktan agar bisa bereaksi. Bayangkan kamu sedang mendaki gunung. Energi aktivasi adalah ketinggian gunung yang harus kamu daki. Katalis seperti jalan pintas, mereka membuat “terowongan” melalui gunung, sehingga kamu tidak perlu mendaki setinggi gunung.
Bayangin kamu lagi masak, tiba-tiba bumbu racikanmu jadi lebih cepet bereaksi, aroma masakan langsung menggoda hidung. Nah, itu kayak peran katalis dalam reaksi kimia, dia mempercepat prosesnya dengan cara meningkatkan energi aktivasi. Kayak kamu mau bikin magnet, butuh proses yang tepat, sebutkan cara membuat magnet , biar magnetnya kuat dan bisa menarik besi.
Begitu juga dengan katalis, dia mempercepat reaksi tanpa ikut bereaksi sendiri, mirip kayak juru masak andal yang ngebantu kamu bikin masakan jadi makin mantap!
Dengan kata lain, katalis membuat jalur reaksi lebih mudah dan cepat.
Katalis, seperti juru masak handal, mempercepat reaksi dengan cara meningkatkan energi aktivasi. Bayangkan, pergaulan bebas ibarat masakan yang siap meledak, dan untuk mencegahnya, kita butuh “katalis” yang tepat. Nah, pergaulan bebas dapat dicegah dengan cara yang benar, seperti pendidikan dan pengawasan, agar “masakan” tetap terkendali dan tidak meledak.
Sama seperti katalis yang mengarahkan reaksi, edukasi dan pengawasan dapat mengarahkan perilaku dan membentuk pribadi yang matang.
Contoh Reaksi Kimia
Salah satu contohnya adalah reaksi penguraian hidrogen peroksida (H 2O 2) menjadi air (H 2O) dan oksigen (O 2). Reaksi ini berjalan lambat pada suhu kamar, tapi dengan menambahkan katalis seperti mangan dioksida (MnO 2), reaksi akan berlangsung jauh lebih cepat.
Katalis MnO 2menyediakan permukaan yang memungkinkan molekul H 2O 2bereaksi lebih mudah, sehingga menurunkan energi aktivasi dan mempercepat reaksi.
Perbandingan Reaksi dengan dan Tanpa Katalis
| Tanpa Katalis | Dengan Katalis | |
|---|---|---|
| Energi Aktivasi | Tinggi | Rendah |
| Energi Bebas Gibbs | Tetap | Tetap |
| Kecepatan Reaksi | Lambat | Cepat |
Jenis-jenis Katalis
Katalis, seperti pahlawan super dalam dunia kimia, dapat mempercepat reaksi kimia tanpa ikut bereaksi sendiri. Mereka bekerja dengan memberikan jalur alternatif yang lebih mudah bagi reaktan untuk berubah menjadi produk. Tapi, seperti pahlawan super yang punya berbagai macam kekuatan, katalis pun memiliki jenisnya masing-masing.
Bayangin, kamu punya resep rahasia bikin kue, tapi resepnya panjang banget kayak sinetron India. Nah, biar cepet bikin kue, kamu perlu katalis, alias cara ngebantu prosesnya. Kayak misalnya, kamu bisa nge-shorten link-nya, biar gampang di-share dan gak bikin orang ngantuk bacanya.
Cara mempersingkat link ini ibarat katalis, ngebantu proses sharing informasi jadi lebih cepet dan gampang dipahami. Makanya, katalis itu penting, biar reaksi kimia berjalan lancar dan hasilnya maksimal, sama kayak nge-shorten link biar nge-share informasi lebih gampang dan efektif!
Katalis Homogen dan Katalis Heterogen
Dunia katalis terbagi menjadi dua kubu: katalis homogen dan katalis heterogen. Keduanya sama-sama membantu reaksi kimia berjalan lebih cepat, tapi cara kerjanya berbeda.
Katalis, layaknya jeruk nipis dalam air putih, bekerja dengan cara meningkatkan energi aktivasi, sehingga reaksi bisa berjalan lebih cepat. Nah, kalau kamu mau bikin minuman menyegarkan yang bisa meningkatkan semangatmu, coba deh cek cara membuat infused water lemon ini.
Rasanya yang asam dan segar bisa jadi katalis buat hari-harimu yang membosankan, lho! Sama seperti katalis yang mempercepat reaksi kimia, infused water lemon bisa mempercepat moodmu, biar kamu semangat menjalani hari.
- Katalis homogenberada dalam fase yang sama dengan reaktan. Bayangkan seperti pesta di mana semua tamu berada di ruangan yang sama, dan katalis adalah tuan rumah yang ramah yang mempermudah interaksi antara para tamu.
- Katalis heterogenberada dalam fase yang berbeda dengan reaktan. Ini seperti pesta di mana tamu-tamu berada di ruang tamu, sementara katalis adalah koki di dapur yang menyiapkan makanan lezat untuk para tamu.
Contoh Katalis Homogen dan Heterogen
Contoh katalis homogen adalah asam kuat seperti asam sulfat (H 2SO 4) yang digunakan dalam reaksi esterifikasi. Asam sulfat akan bercampur dengan reaktan (alkohol dan asam karboksilat) dalam fase cair, mempercepat reaksi pembentukan ester.
Contoh katalis heterogen adalah nikel (Ni) yang digunakan dalam reaksi hidrogenasi. Nikel padat akan bertindak sebagai permukaan tempat reaktan (alkena) melekat dan bereaksi dengan hidrogen, membentuk alkana.
Perbandingan Katalis Homogen dan Heterogen
| Karakteristik | Katalis Homogen | Katalis Heterogen |
|---|---|---|
| Fase | Sama dengan reaktan | Berbeda dengan reaktan |
| Mekanisme Reaksi | Interaksi langsung dengan reaktan | Adsorpsi reaktan pada permukaan katalis |
| Contoh Aplikasi | Esterifikasi, hidrolisis, polimerisasi | Hidrogenasi, oksidasi, dehidrogenasi |
Mekanisme Katalis
Katalis adalah zat ajaib yang mempercepat reaksi kimia tanpa ikut bereaksi sendiri. Bayangkan seperti seorang juru parkir handal yang membantu mobil-mobil masuk dan keluar dari garasi dengan cepat dan efisien, tanpa harus ikut masuk ke dalam mobil! Nah, katalis bekerja dengan cara yang mirip, membantu molekul-molekul bereaksi lebih cepat, tanpa harus ikut berubah sendiri.
Tapi bagaimana caranya? Yuk, kita bongkar rahasia mekanismenya!
Langkah-Langkah Umum dalam Mekanisme Reaksi Katalitik
Secara umum, reaksi katalitik melibatkan beberapa langkah kunci:
- Adsorpsi:Molekul reaktan menempel pada permukaan katalis. Bayangkan seperti dua orang yang berpegangan tangan untuk melakukan suatu aktivitas bersama. Katalis berperan sebagai tempat pertemuan yang nyaman dan aman bagi molekul-molekul reaktan untuk saling berdekatan.
- Aktivasi:Katalis membantu molekul reaktan mencapai keadaan transisi, yaitu keadaan energi tinggi yang diperlukan untuk reaksi berlangsung. Katalis seperti seorang pelatih yang memotivasi dan mendorong atlet untuk mencapai puncak performanya.
- Reaksi:Molekul reaktan bereaksi membentuk produk. Ini seperti atlet yang akhirnya berhasil menyelesaikan perlombaan dengan hasil yang memuaskan.
- Desorpsi:Produk terlepas dari permukaan katalis. Katalis seperti seorang pelatih yang melepaskan atlet setelah menyelesaikan perlombaan dan siap untuk tantangan berikutnya.
Contoh Reaksi Katalitik dan Mekanisme Langkah Demi Langkah
Sebagai contoh, mari kita lihat reaksi dekomposisi hidrogen peroksida (H2O 2) menjadi air (H 2O) dan oksigen (O 2) yang dikatalisis oleh enzim katalase.
- Adsorpsi:Molekul H 2O 2menempel pada sisi aktif enzim katalase.
- Aktivasi:Katalase membantu memecah ikatan O-O dalam H 2O 2, membuatnya lebih mudah bereaksi.
- Reaksi:H 2O 2terurai menjadi H 2O dan O 2.
- Desorpsi:Produk (H 2O dan O 2) terlepas dari permukaan katalase.
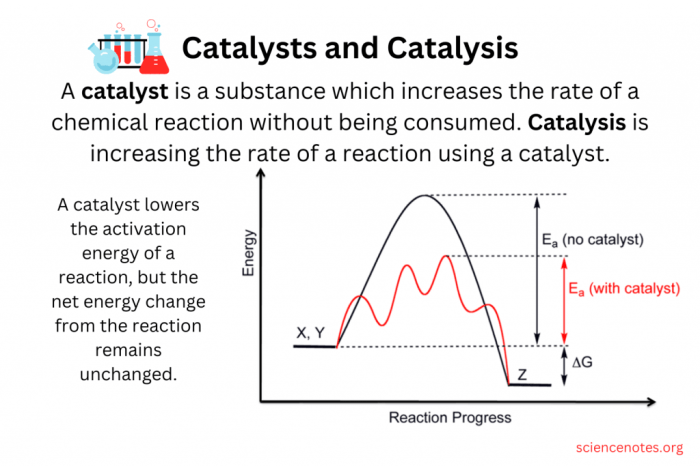
Ilustrasi Perubahan Energi Potensial Selama Reaksi Katalitik
Perubahan energi potensial selama reaksi katalitik dapat diilustrasikan dengan diagram berikut:[Gambar ilustrasi perubahan energi potensial selama reaksi katalitik]Diagram ini menunjukkan bahwa katalis menurunkan energi aktivasi reaksi, sehingga reaksi berlangsung lebih cepat. Reaksi tanpa katalis membutuhkan energi aktivasi yang lebih tinggi (garis biru), sedangkan reaksi dengan katalis membutuhkan energi aktivasi yang lebih rendah (garis merah). Katalis juga membentuk keadaan transisi yang lebih stabil (puncak bukit yang lebih rendah), sehingga reaksi lebih mudah terjadi. Reaksi katalitik juga melewati intermediat, yaitu senyawa antara yang terbentuk selama reaksi.
Aplikasi Katalis
Katalis, seperti juru masak handal di dunia kimia, mempercepat reaksi tanpa ikut bereaksi sendiri. Kemampuannya ini membuat mereka menjadi pemain kunci dalam berbagai bidang, mulai dari industri hingga tubuh kita sendiri.
Industri Kimia, Suatu katalis mempercepat reaksi dengan cara meningkatkan
Bayangkan sebuah pabrik kimia raksasa, di mana katalis berperan sebagai “penyihir” yang merubah bahan baku menjadi produk yang kita gunakan sehari-hari.
- Sintesis Amonia:Proses Haber-Bosch, yang menggunakan katalis besi, mengubah nitrogen dan hidrogen menjadi amonia. Amonia ini penting untuk pupuk dan berbagai produk lainnya.
- Pembuatan Bensin:Katalis seperti zeolit dan platinum digunakan dalam proses crackingdan reforminguntuk mengubah minyak mentah menjadi bensin, yang menjadi bahan bakar kendaraan kita.
Lingkungan
Katalis juga berperan penting dalam menjaga lingkungan kita.
- Pemurnian Gas Buang:Katalis dalam konverter katalitik mobil mengubah gas buang beracun seperti karbon monoksida dan nitrogen oksida menjadi gas yang lebih ramah lingkungan.
- Pemisahan Senyawa Organik:Katalis dapat digunakan untuk memecah senyawa organik berbahaya, seperti pestisida, menjadi senyawa yang tidak berbahaya.
Biologi
Katalis biologi, yang dikenal sebagai enzim, bekerja di dalam tubuh kita untuk menjalankan berbagai reaksi kimia yang vital.
- Pencernaan:Enzim seperti amilase dan protease membantu kita mencerna makanan.
- Pernapasan:Enzim dalam sel kita membantu mengubah glukosa menjadi energi yang kita butuhkan untuk hidup.
